Fostre fra zebrafisk hjælper med at vise, hvad der sker med nanopartikler i blodet
30.9.2020 12:41:30 CEST | Aarhus Universitet Natural Sciences | Pressemeddelelse
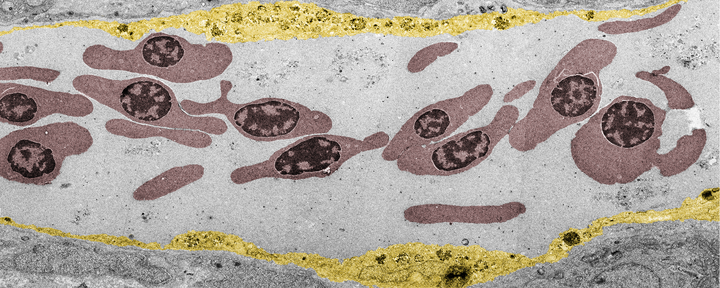
En række nanopartikler er designet til drug delivery – altså præcis aflevering af et lægemiddel til syge celler i fx tumorer – men desværre når kun en meget lille del af de injicerede nanopartikler det tilsigtede mål. Årsagen til den lave succes med at nå målet betragtes ofte som en "sort boks" og har således ikke været udforsket ret meget i mange år.
For nyligt demonstrerede en international forskergruppe ledet af Yuya Hayashi fra Institut for Molekylærbiologi og Genetik (MBG), Aarhus Universitet, den store fordel ved at bruge fostre (embryoner) fra zebrafisk i nano-biovisualisering, der kan visualisere dynamiske interaktioner mellem nanopartikler og celler af interesse i en levende organisme (se artiklen "Zebrafisk lader dig se nanopartiklers skæbne i den levende organisme").
Sammen med forskere fra Interdisciplinary Nanoscience Center (iNANO) forsøger Yuya nu at besvare uløste mysterier inden for bionanoscience – den første i rækken er det biologiske identitetskoncept, der forklarer, hvordan celler genkender nanopartiklerne gennem en ”skal” (engelsk: "corona") af proteiner, der omgiver hver partikel. Dette koncept er nu blevet bevist for første gang i en levende organisme ved brug af zebrafisk-embryoner, der afdækker, hvad der sker med nanopartikler, der injiceres i blodet.
Ven eller fjende? Sådan genkender biologiske systemer nanopartikler
Den videnskabelige artikel "What the Cell Sees in Bionanoscience" er en af de første publikationer, der har defineret, hvordan en skal af proteiner dannes omkring en nanopartikel, og hvordan en sådan proteinskal viser, at der er et behov for at gentænke den måde, vi ser på nanopartikler inden for et biologisk miljø.
Fra omfattende forskning gennem de seneste ti år forstår vi nu, at to modsatrettede virkninger hovedsageligt er årsag til cellers optagelse af nanopartikler. Generelt forhindrer proteinskallen, at der sker en direkte fysisk interaktion mellem overfladen af nanopartiklen og cellemembranen. Men hvad hvis proteinskallen indeholder et signal, der udløser en specifik biologisk interaktion med receptorer, der er findes i cellemembranen? Det er noget, cellen ser og dermed giver det en biologisk identitet til nanopartiklen.
Ved at bruge zebrafisk-embryoer som model har forskergruppen således leveret de første "visuelle" beviser for, hvordan proteinskallen bidrager til uønsket fjernelse af nanopartiklernes fra blodet. Forskergruppen brugte proteiner fra en anden dyreart til dannelsen af skallen for at skabe en "fremmed" biologisk identitet, hvorefter de fulgte nanopartiklernes rejse gennem zebrafisk-embryonernes blodkar og til deres endelige destination - endolysosomerne i cellen. Dette afslørede en overraskende hurtig optagelse og forsuring af nanopartiklerne i scavenger-endotelceller (der har en funktion tilsvarende sinusoidale endotelceller i leveren i pattedyr) efterfulgt af proinflammatorisk aktivering af makrofager (se videoen på Yuyas gruppehjemmeside).
"Umiddelbart lyder det som en skør idé at injicere nanopartikler med proteiner fra et andet dyr," siger Yuya Hayashi, "men for eksempel testes nanomediciner, der er inspireret af biomolekyler, i en musemodel uden særlig bekymring for den denne blanding af arter. Ellers humaniserer nogle folk musen for at løse problemet med blandingen af arter. Selv på cellekulturniveau testes nanopartikler faktisk stadig rutinemæssigt i henhold til traditionen for at bruge serum fra køer, selv om man ved, at nanopartikel-protein-interaktioner er den vigtigste funktion ved cellulær optagelse."
"Det der gør denne form for eksperiment specielt udfordrende," tilføjer første forfatter Hossein Mohammad-Beigi, "er at opretholde den oprindelige proteinskal bedst muligt i en levende organisme. Hvis den foruddannede skal hurtigt udveksles af endogene blodproteiner, bliver den testede hypotese værdiløs. Vi har gjort en hel del bestræbelser på at karakterisere proteinetskallen for at sikre, at nanopartiklerne bevarer deres ikke-selvbiologiske identitet. "
At se er at tro – zebrafiskmodellen kan noget, som gnavermodeller ikke kan
Den største fordel ved at bruge zebrafisk som model er, at den muliggør dannelse af et flerfarvet realtidsbillede, hvorved flere kombinationer af fluorescens-sporstoffer og reporterproteiner kan afbildes i en enkel opsætning ved høj rum-tidsmæssig opløsning. Dette giver en ny mulighed, der ligger mellem mindre realistiske cellekultursystemer og mere udfordrende gnavereksperimenter såsom intravital mikroskopi.
"Ved at bruge cellekulturer har vi lært en hel del om, hvordan celler genkender nanopartikler som dynamiske aggregater af proteiner, men det blev aldrig testet i en mere realistisk situation," forklarer Yuya. "Med etableringen af zebrafiskemodellen har vi endelig fået en måde til at undersøge dette spørgsmål yderligere i en levende organisme. Det var en enkel tilgang med et ekstremt scenario testet i et meget komplekst system, men jeg tror, vi er nu et skridt nærmere forståelsen af, hvad proteinskallen virkelig kan betyde for nanopartikler. I et miljø rigt på proteiner kan nanopartikler bære en maske, der giver dem en biologisk identitet, og dens fremmedhed kan gøre dem til en fjende. Hvad definerer graden af fremmedhed? Ja, det er det næste store spørgsmål, vi skal tage fat på."
Forskningen blev udført med hjælp fra zebrafiskefaciliteten ved Institut for Molekylærbiologi og Genetik (MBG) ledet af Kasper Kjær-Sørensen og Claus Oxvig fra MBG, Aarhus Universitet. Forskningen er finansieret af bevillinger fra Lundbeck Foundation og Danmarks Frie Forskningsfond | Teknologi og Produktion.
To artikler er offentliggjort i det meget anerkendte tidsskrift inden for nanovidenskab, ACS Nano:
- "Tracing the In Vivo Fate of Nanoparticles with a Non-Self Biological Identity" by Hossein Mohammad-Beigi, Carsten Scavenius, Pia Bomholt Jensen, Kasper Kjær-Sørensen, Claus Oxvig, Thomas Boesen, Jan J. Enghild, Duncan S. Sutherland, and Yuya Hayashi*.
ACS Nano 14 (2020) pp. 10666–10679. https://doi.org/10.1021/acsnano.0c05178 - Differential Nanoparticle Sequestration by Macrophages and Scavenger Endothelial Cells Visualized in Vivo in Real-Time and at Ultrastructural Resolution by Yuya Hayashi*, Masanari Takamiya, Pia Bomholt Jensen, Isaac Ojea-Jiménez, Hélicia Claude, Claude Antony, Kasper Kjær-Sørensen, Clemens Grabher, Thomas Boesen, Douglas Gilliland, Claus Oxvig, Uwe Strähle, and Carsten Weiss.
ACS Nano 14 (2020) pp. 1665-1681. https://doi.org/10.1021/acsnano.9b07233.
Kontakter
Adjunkt Yuya Hayashi
Institut for Molekylærbiologi og Genetik
Aarhus Universitet
yuya.hayashi@mbg.au.dk
Forskningsgruppehjemmeside: https://mbg.au.dk/yuya-hayashi/
Billeder
Links
Information om Aarhus Universitet Natural Sciences
Følg pressemeddelelser fra Aarhus Universitet Natural Sciences
Skriv dig op her, og modtag pressemeddelelser på e-mail. Indtast din e-mail, klik på abonner, og følg instruktionerne i den udsendte e-mail.
Flere pressemeddelelser fra Aarhus Universitet Natural Sciences
Hurtigvoksende træer tager over i fremtidens skove og sætter biodiversiteten under pres29.1.2026 12:03:14 CET | Pressemeddelelse
Klimakrise, skovrydning og ødelagte levesteder fremmer ensartede skove, hvor hurtigvoksende arter fortrænger oprindelige træer. Det sænker biodiversiteten, gør træerne mindre modstandsdygtige over for sygdom og reducerer skovenes evne til at lagre CO₂.
Kenyas store katte under pres – kvæg presser løverne væk26.1.2026 11:24:01 CET | Pressemeddelelse
Flokke af kvæg fordriver løver og andre vilde dyr fra deres levesteder i Kenya – også selv om hyrderne lukker kvæget inde om natten, når rovdyrene er aktive. Et nyt studie fra Aarhus Universitet peger på løsninger, der kan mindske konflikterne mellem husdyr og vilde dyr.
Gennembrud: Nu kan vi aflæse DNA med telefonen17.12.2025 09:10:19 CET | Pressemeddelelse
Dansk forskningsgruppe har designet proteiner, der kan lede efter bestemte DNA-stykker og lyse, hvis de finder dem. Et lys, telefonens kamera nemt kan fange.
Professor Lars Birkedal – 25-års jubilæum20.11.2025 13:08:31 CET | Pressemeddelelse
Professor i datalogi ved Aarhus Universitet, Lars Birkedal, kan fejre 25-års jubilæum. Han er internationalt anerkendt for sin forskning i programmeringssprog og programverifikation og leder Center for Basic Research in Program Verification. Han har modtaget flere store forskningspriser, bl.a. EliteForsk-prisen.
Professor Ivan Damgård – 40-års jubilæum20.11.2025 13:04:06 CET | Pressemeddelelse
Professor i datalogi ved Aarhus Universitet, Ivan Damgård, kan fejre 40-års jubilæum. Han er internationalt anerkendt pioner inden for kryptografi og har været med til at grundlægge virksomederne Cryptomathic og Partisia. Han er Ridder af Dannebrog og aktiv folkemusiker.
I vores nyhedsrum kan du læse alle vores pressemeddelelser, tilgå materiale i form af billeder og dokumenter samt finde vores kontaktoplysninger.
Besøg vores nyhedsrum